刘颖1,陈雄1,廖蓓2,李志军2,王志1*
1(湖北工业大学,发酵工程教育部重点实验室,湖北省工业发酵协同创新中心,湖北省工业微生物重点实验室,武汉,430068) 2(安琪酵母股份有限公司,湖北 宜昌,443000)
摘 要为了研究新型抑菌剂在酒精发酵染菌控制中的应用,从工业酒精发酵污染液分离出主要污染菌HG-201,其16S rDNA与Pantoeaananatis(JX215331)的核苷酸序列同源性为99%。在菌株HG-201生长对数中期添加新型抑菌剂葡萄糖氧化酶和溶菌酶,以确定对菌株HG-201的抑菌效果。将酿酒酵母与菌株HG-201以1∶30的接种比例进行混合培养,并在发酵开始添加低浓度的抑菌剂。结果表明:10 U/mL的葡萄糖氧化酶和0.25 g/L的溶菌酶即可完全抑制菌株HG-201的生长和代谢,并且在实验条件下对酿酒酵母生长以及乙醇的产量没有影响,为新型抑菌剂在工业酒精发酵杂菌控制中的应用提供了参考。
关键词:酒精发酵;污染菌;葡萄糖氧化酶;溶菌酶
酿酒酵母工业酒精发酵使用淀粉类原料做碳源,为了维持糖化酶活性,糖化过程温度只有50 ℃左右。同时工业酒精发酵设备管道繁多,厌氧或兼性厌氧污染菌可由原料、水、空气、管道以及设备死角等带入发酵过程,因此,酒精发酵不是严格无菌的过程[1-2]。这些污染菌繁殖会消耗大量的碳源、氮源和氨基酸等营养物质,从而降低酵母生长速率,减少生物量,甚至导致酵母的死亡[3-4]。常见的污染菌一般有醋酸菌[5]和乳酸菌[6],它们可以在低pH、高酒精度以及低溶氧下生存,并且生成乙酸和乳酸。此外,污染菌的酸代谢会降低发酵液的pH,抑制酵母菌、淀粉酶和糖化酶的活力,降低酒精的产率[7-9]。
为了抑制工业酒精发酵过程中的杂菌污染,工业上一般应用酸处理或者添加抗生物素的方法。酸处理是添加硫酸到酵母发酵醪中,利用酵母对氢离子的耐受性强于细菌的特性,维持pH值为3.5左右以抑制杂菌的生长[10]。酸处理不当可能会降低酵母的活性,废液中硫离子浓度过高也会增加废水处理的难度,对环境有较大污染,不能作为工业上控制酒精发酵过程染菌的长久方法[11-12];而添加抗生素如青霉素、氯霉素、土霉素等,除了很容易产生细菌耐药性以外,抗生素也会残留在酒槽中,从而对食品安全和公共安全造成严重威胁[13],已经被我国严禁添加。
具有抑菌生物活性的天然化合物如植物提取物[14]和功能酶[15]等新型抑菌剂可以有效抑制污染的杂菌,同时不会对环境造成危害[16]。随着环境保护逐渐受到政府和社会的高度重视,新型抑菌剂的应用成为解决工业酒精发酵杂菌污染的环境友好型途径之一,如:葡萄糖氧化酶可以专一地将葡萄糖氧化成葡萄糖酸和过氧化氢,葡萄糖酸能够降低发酵液中pH值,同时过氧化氢是广谱杀菌剂,均可以达到抑菌效果[17]。溶菌酶可以水解细菌细胞壁肽聚糖起到抑菌作用,对没有肽聚糖组分的酵母细胞壁没有影响。
本文对酒精发酵污染液中的杂菌进行分离、纯化和鉴定,确定杂菌主要为泛菌。由于文献中报道酒精发酵污染菌主要是醋酸菌和乳酸菌,而泛菌很少报道。因此,通过酵母-泛菌混合发酵模拟染菌状态,并侧重研究了不同抑菌剂(葡萄糖氧化酶、溶菌酶)对泛菌和酵母生长代谢的影响,旨在为工业酒精发酵过程中对杂菌的控制提供理论依据和技术指导。
1.1主要材料、试剂与仪器
酒精发酵污染液(来源于安特食品股份有限公司)、葡萄糖氧化酶和溶菌酶(由安琪酵母股份有限公司提供)。
DELTA 320 pH计,梅特勒托利多仪器(上海)有限公司;立式压力蒸汽灭菌器,上海精宏实验设备有限公司;Nikon ECLIPSE E100生物显微镜,上海光学仪器五厂;TG18M台式高速离心机,长沙平凡仪器仪表有限公司;HNY-211B全温振荡培养箱,天津欧诺仪器仪表有限公司;UVmini-1240紫外可见分光光度计,岛津;生物传感仪SBA-40,山东省科学院生物研究所;THOMA细菌计数板,深度0.02 mm,每个小方格面积1/400 mm2。
1.2培养基
富集培养基 (g/L):葡萄糖20,蛋白胨10,酵母浸粉5,NaCl 10,琼脂粉20。培养基中加入抗真菌剂(如放线菌酮和制霉素),质量浓度为50 μg/mL,以抑制真菌的生长。
基础培养基 (g/L): 葡萄糖10,酵母浸粉2,蛋白胨10,NaCl 10。
YEPD培养基 (g/L): 葡萄糖20,蛋白胨10,酵母浸粉10。
酿酒酵母混菌发酵培养基 (g/L): 葡萄糖60,酵母浸粉10,蛋白胨10,K2HPO41.5,MgSO41.0,(NH4)2SO41.5,NaCl 1.0,CaCl21.0。
培养基配好后分装至250 mL摇瓶,115 ℃灭菌15 min。
1.3培养方法
1.3.1 污染菌株的分离纯化
吸取1 mL充分摇匀的污染液于9 mL无菌水中,采用10倍梯度稀释法制成10-4、10-5、10-6、10-7稀释液度稀释,涂布于富集培养基平板上,放置30℃培养箱,培养24 h后根据菌落形态特征,挑取不同的单菌落,番红染色镜检。挑取菌体形态不同的单菌落再次划线培养,重复多次获得纯种。
1.3.2 16S rDNA基因序列分析
用DNA提取盒提取分离到菌株的DNA,对获得的总基因组DNA进行16S rDNA的PCR扩增。采用的引物分别为:27f: AGAGTTTGATCMTGGCTCAG ;1492R: TACGGYTACCTTGTTACGACTT
扩增条件:预变性95 ℃ 5 min;变性95 ℃ 30 s;退火62 ℃ 30 s;延伸72℃ 1 min;35cycle;72 ℃ 10 min,20 ℃ forever。将PCR片段回收、测序。将测序结果到NCBI数据库里进行序列比对。
1.3.3 污染菌株生长曲线测定
将污染菌接至基础培养基试管斜面上,30 ℃活化24 h,加入10 mL无菌水制备种子菌悬液。以10%(v/v)的接种量接入种子摇瓶(装液量50 mL,基础培养基),在30 ℃、200 r/min条件下培养24 h,获得二级种子液。再以10%(v/v)的接种量转接入发酵摇瓶(装液量25 mL,基础培养基),在30 ℃、100 r/min条件下培养。周期取样,用分光光度法测菌悬液OD600 nm,绘制生长曲线。
1.3.4 抑菌剂浓度的确定
选用葡萄糖氧化酶的浓度为0、5、10、20、30 U/mL;溶菌酶的质量浓度为0、0.25、0.5、1、2 g/L,分别经0.22 μm的滤膜过滤后备用。
在污染菌的发酵对数中期添加不同浓度的抑菌剂,周期取样,分光光度法测菌悬液OD600 nm。根据污染菌生长速率的变化确定抑菌浓度。
1.3.5 抑菌剂对酿酒酵母的作用
将酿酒酵母接至YEPD斜面(2%琼脂)活化12 h,加入10 mL无菌水制备种子菌悬液,以10%(v/v)的接种量转接至种子摇瓶(装液量50 mL,YEPD培养基),在30 ℃、200 r/min条件下培养培养12 h,获得二级种子液,再以10%接种量转接至发酵摇瓶(装液量50 mL,YEPD培养基)。接种时分别加入两种抑菌剂(10 U/mL的葡萄糖氧化酶和0.25 g/L的溶菌酶),周期取样,分光光度法测菌体悬浮液OD600 nm。
1.3.6 酿酒酵母与HG-201菌株混合发酵与抑菌剂评价
1.3.6.1 酿酒酵母与HG-201菌株混合发酵最适接种比例的确定
制备酿酒酵母和污染菌二级种子液,无菌取样稀释,用细菌计数板对二级种子液中酵母(40倍镜)和污染菌(100倍油镜)分别计数。计算接种体积,使发酵培养基中酿酒酵母接种总细胞数为3.2×108个,发酵起始的细胞浓度为6.4×106/mL。将3.2×108个酿酒酵母细胞与不同体积的污染菌种子液接入新鲜混合发酵培养基中(装液量50 mL,混菌发酵培养基),使酿酒酵母与污染菌的细胞数比例为1∶10、1∶30、1∶50和1∶100。以只接3.2×108个酿酒酵母细胞的摇瓶作为对照。在30 ℃,200 r/min条件下培养12 h后取样计数。酵母细胞生长被明显抑制的实验组确定为最适接种比例。
1.3.6.2 酿酒酵母与污染菌株混合发酵与添加抑菌剂效果评价
按照1.3.6.1所述培养方法将酿酒酵母细胞和污染菌二级种子液按最适接种比例接入新鲜混合发酵培养基中(装液量50 mL,混菌发酵培养基),发酵起始酵母细胞浓度为6.4×106/mL。后采用如下设计进行抑菌剂抑菌效果评价实验。(1) 只接酵母;(2) 接酵母和污染菌;(3) 接酵母和污染菌同时添加葡萄糖氧化酶;(4) 接酵母和污染菌并添加溶菌酶。周期取样,用细菌计数板计数。根据不同条件下酵母菌和污染菌的生长情况评价抑菌剂抑菌效果。
1.4测定方法
1.4.1 菌体浓度测定
使用分光光度法测定:将样品稀释一定浓度,吸取5 mL至10 mL离心管中,6 500 r/min离心5 min,取上清做对照,测稀释后的菌悬液OD600 nm值。
1.4.2 菌体数测定
使用细菌计数板计数。
1.4.3 挥发性脂肪酸(VFA)的测定
采用比色法[18]。
1.4.4 乙醇测定
使用生物传感仪测定。
1.5数据处理
所有实验数据为3个重复的平均值±标准偏差,采用origin 8.0对实验数据分析。
2 结果与分析
2.1污染菌分离纯化与镜检
稀释度为10-6的富集培养基平板上菌落形态分为3种,其中75%为乳白色、大而圆润的菌落,镜检发现细胞存在明显的出芽生殖特点,判断为酒精发酵的生产菌株——酿酒酵母。另外,还存在约20%的黄色、小且光滑的菌落和约5%的白色褶皱菌落,分别镜检,初步判断为杆状细菌。前者保存命名为HG-201,后者保存命名为HG-202。显然,实验条件下主要污染的杂菌为菌株HG-201,因此,后续实验均以HG-201为研究对象。
2.216SrDNA基因序列分析
2.2.1 菌株HG-201的16S rDNA基因片段PCR产物扩增电泳图(图1)
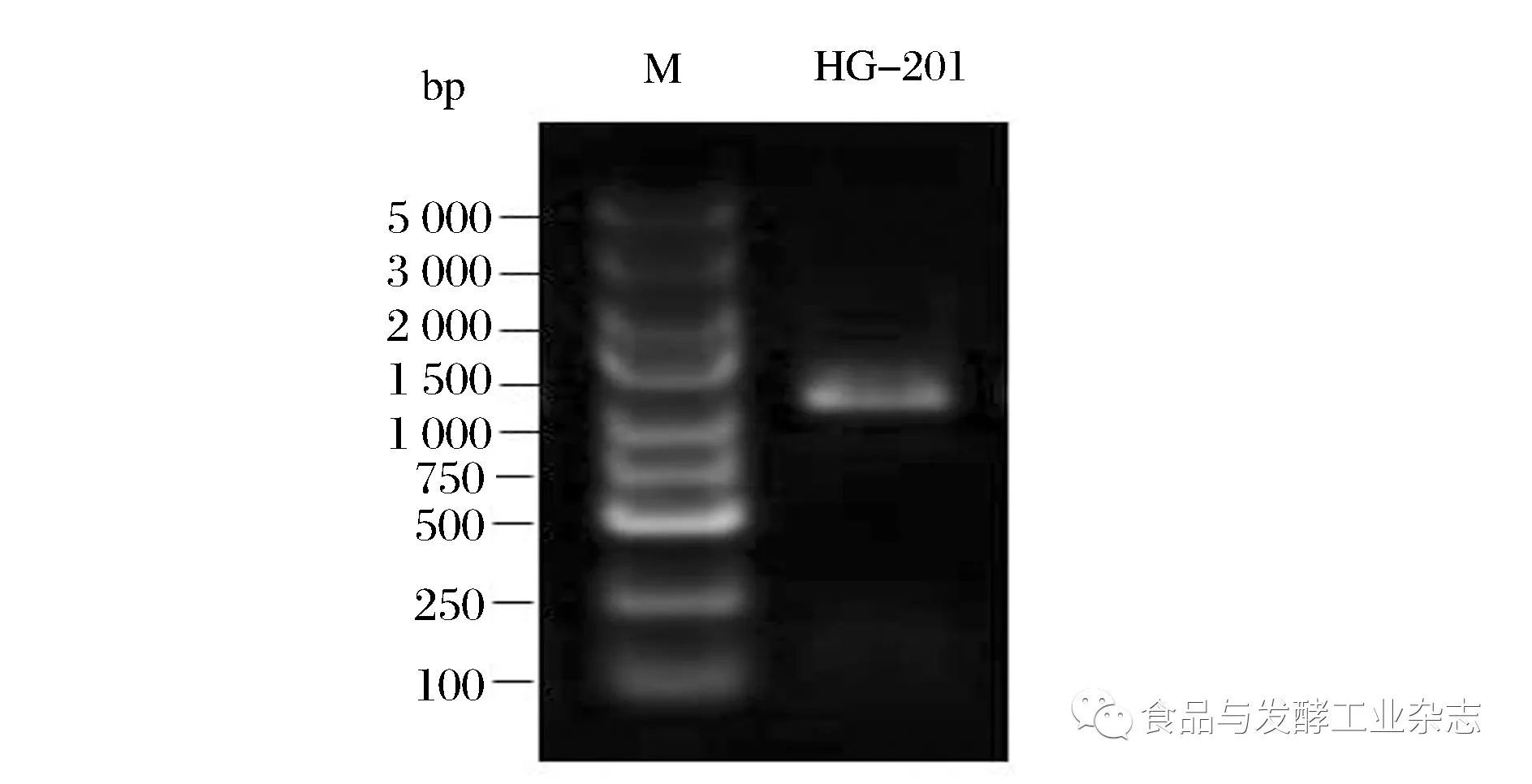
图1 菌株HG-201的16S rDNA PCR扩增产物电泳图
Fig.1 16S rDNA PCR electropherogram of strain HG-201
2.2.2 菌株HG-201 的16S rDNA基因序列
测序结果如下:
ATCATACGGAGCTACCATGCAGTCGGACGGTA ̄GCAC ̄AGAGGAGC ̄TTG ̄CTCC ̄TTG ̄GGTGACGAG ̄TG ̄G ̄C ̄G ̄GA ̄CG ̄GGTGAGTAATGTCTG ̄GGGATCTGCCCGATA ̄GAGGGGGAT ̄AACCACT ̄GGAAACGGTGGCTAATA ̄C ̄C ̄G ̄CA ̄TA ̄ACGTCGC ̄AAG ̄ACCAAA ̄GAGGG ̄GGACCT ̄TC ̄G ̄G ̄GC ̄CTCTCA ̄CTATCG ̄GATGAAC ̄CCAGATGGGATT ̄A ̄G ̄C ̄T ̄A ̄G ̄TA ̄G ̄G ̄C ̄G ̄G ̄G ̄G ̄T ̄A ̄A ̄TG ̄G ̄C ̄C ̄C ̄AC ̄C ̄T ̄AG ̄GCG ̄A ̄C ̄G ̄ATC ̄CCTA ̄GCT ̄GGT ̄TGAGA ̄GG ̄AT ̄GA ̄CCA ̄G ̄C ̄C ̄A ̄C ̄A ̄C ̄T ̄G ̄G ̄A ̄ACTGAGA ̄C ̄AC ̄GGT ̄C ̄ ̄C ̄AGAC ̄T ̄C ̄C ̄T ̄A ̄C ̄GGGAG ̄G ̄C ̄ ̄A ̄G ̄C ̄ ̄A ̄GT ̄GG ̄GG ̄A ̄A ̄T ̄A ̄ ̄T ̄T ̄GC ̄A ̄C ̄A ̄A ̄ ̄T ̄GGGC ̄ ̄GC ̄A ̄A ̄GC ̄ ̄C ̄ ̄T ̄ ̄G ̄A ̄ ̄T ̄G ̄C ̄A ̄GC ̄C ̄A ̄ ̄T ̄GC ̄C ̄ ̄G ̄C ̄G ̄T ̄G ̄T ̄ ̄A ̄T ̄G ̄A ̄A ̄ ̄G ̄A ̄A ̄G ̄G ̄C ̄C ̄T ̄T ̄C ̄ ̄G ̄G ̄G ̄T ̄T ̄ ̄G ̄T ̄A ̄A ̄A ̄G ̄T ̄A ̄C ̄T ̄T ̄T ̄C ̄ ̄A ̄G ̄ ̄C ̄G ̄G ̄G ̄G ̄ ̄A ̄G ̄G ̄A ̄ ̄A ̄G ̄G ̄C ̄G ̄A ̄ ̄T ̄G ̄C ̄G ̄G ̄T ̄T ̄ ̄A ̄A ̄T ̄A ̄A ̄C ̄ ̄C ̄G ̄C ̄G ̄T ̄ ̄C ̄G ̄A ̄T ̄ ̄T ̄G ̄A ̄C ̄G ̄T ̄ ̄T ̄A ̄C ̄C ̄C ̄G ̄C ̄A ̄ ̄G ̄A ̄ ̄A ̄G ̄A ̄A ̄G ̄C ̄A ̄C ̄C ̄G ̄G ̄C ̄T ̄A ̄A ̄C ̄ ̄T ̄C ̄C ̄G ̄T ̄G ̄C ̄C ̄A ̄G ̄C ̄A ̄G ̄C ̄C ̄G ̄C ̄G ̄G ̄T ̄A ̄A ̄T ̄A ̄C ̄G ̄G ̄A ̄G ̄G ̄G ̄T ̄G ̄C ̄A ̄A ̄G ̄C ̄G ̄T ̄T ̄A ̄A ̄T ̄C ̄G ̄G ̄A ̄A ̄T ̄T ̄A ̄C ̄T ̄G ̄G ̄G ̄C ̄G ̄T ̄A ̄A ̄A ̄G ̄C ̄G ̄C ̄A ̄C ̄G ̄C ̄A ̄G ̄G ̄C ̄G ̄G ̄T ̄C ̄T ̄G ̄T ̄T ̄A ̄A ̄G ̄ ̄T ̄C ̄A ̄G ̄A ̄T ̄G ̄T ̄ ̄G ̄A ̄A ̄A ̄T ̄C ̄C ̄C ̄C ̄G ̄G ̄G ̄C ̄T ̄T ̄A ̄A ̄C ̄C ̄T ̄G ̄G ̄G ̄A ̄ ̄A ̄C ̄T ̄G ̄C ̄A ̄T ̄T ̄T ̄G ̄A ̄A ̄A ̄C ̄T ̄G ̄G ̄C ̄A ̄G ̄G ̄C ̄T ̄T ̄G ̄ ̄A ̄G ̄T ̄C ̄T ̄T ̄G ̄T ̄A ̄G ̄A ̄G ̄G ̄G ̄G ̄G ̄G ̄T ̄A ̄G ̄A ̄ ̄A ̄T ̄T ̄C ̄C ̄A ̄G ̄G ̄T ̄G ̄T ̄A ̄G ̄C ̄G ̄G ̄T ̄G ̄A ̄A ̄A ̄ ̄T ̄G ̄C ̄G ̄T ̄A ̄G ̄A ̄G ̄A ̄T ̄C ̄T ̄G ̄G ̄A ̄G ̄G ̄A ̄A ̄T ̄A ̄C ̄C ̄G ̄G ̄T ̄G ̄G ̄C ̄G ̄A ̄A ̄G ̄G ̄C ̄G ̄G ̄C ̄C ̄C ̄C ̄C ̄T ̄G ̄ ̄G ̄A ̄C ̄A ̄A ̄A ̄G ̄A ̄C ̄T ̄G ̄A ̄C ̄ ̄G ̄C ̄T ̄C ̄G ̄G ̄T ̄G ̄C ̄G ̄A ̄ ̄A ̄A ̄G ̄C ̄G ̄T ̄G ̄G ̄G ̄G ̄A ̄G ̄C ̄A ̄A ̄A ̄C ̄A ̄G ̄G ̄A ̄T ̄T ̄ ̄A ̄G ̄A ̄T ̄A ̄C ̄C ̄C ̄T ̄G ̄G ̄T ̄A ̄G ̄T ̄ ̄C ̄C ̄A ̄C ̄G ̄C ̄C ̄G ̄T ̄A ̄A ̄A ̄C ̄G ̄A ̄T ̄G ̄T ̄C ̄G ̄A ̄C ̄T ̄T ̄G ̄G ̄A ̄G ̄G ̄T ̄T ̄G ̄T ̄T ̄C ̄C ̄ ̄C ̄T ̄T ̄G ̄A ̄G ̄G ̄A ̄G ̄ ̄T ̄G ̄G ̄C ̄T ̄T ̄C ̄C ̄G ̄G ̄A ̄G ̄C ̄T ̄A ̄A ̄C ̄G ̄C ̄ ̄G ̄T ̄T ̄A ̄A ̄G ̄T ̄C ̄G ̄A ̄C ̄C ̄G ̄C ̄C ̄T ̄G ̄G ̄G ̄G ̄A ̄G ̄T ̄A ̄C ̄G ̄ ̄G ̄C ̄C ̄G ̄C ̄A ̄A ̄G ̄G ̄ ̄T ̄T ̄A ̄A ̄A ̄C ̄T ̄C ̄A ̄A ̄A ̄T ̄G ̄A ̄A ̄T ̄T ̄G ̄A ̄C ̄G ̄G ̄G ̄G ̄G ̄C ̄C ̄C ̄G ̄C ̄A ̄C ̄A ̄ ̄A ̄G ̄C ̄G ̄G ̄T ̄G ̄G ̄A ̄G ̄C ̄A ̄T ̄G ̄ ̄T ̄G ̄G ̄T ̄T ̄T ̄A ̄A ̄T ̄T ̄C ̄G ̄A ̄T ̄G ̄ ̄C ̄A ̄A ̄C ̄G ̄C ̄G ̄A ̄A ̄G ̄A ̄T ̄C ̄T ̄T ̄T ̄A ̄ ̄ ̄C ̄C ̄T ̄A ̄C ̄T ̄C ̄T ̄T ̄G ̄A ̄C ̄A ̄ ̄T ̄C ̄C ̄A ̄G ̄C ̄G ̄A ̄A ̄C ̄T ̄ ̄T ̄G ̄G ̄C ̄A ̄G ̄A ̄G ̄A ̄T ̄G ̄ ̄C ̄A ̄T ̄T ̄A ̄G ̄T ̄G ̄C ̄T ̄T ̄C ̄ ̄G ̄G ̄A ̄A ̄C ̄CT ̄G ̄A ̄G ̄A ̄
2.2.3 菌株HG ̄-201的16S rDNA基因发育树
菌株HG-201的16S rDNA核苷酸序列在NCBI中BLAST后,结果显示它与Pantoeaananatis菌的16S rDNA的核苷酸序列同源性为99%。用MEGA软件构建系统发育树(图2),表明菌株HG-201在Pantoea属进化树一个分支上,与Pantoeaananatis种的菌株在一个类群内而与其他种处于不同的分枝。

图2 菌株HG-201基于16S rDNA基因发育树图
Fig.2 16S rDNA gene-based phylogenetic tree of strain HG-201
玉米基质燃料乙醇发酵工艺通常为40~50 ℃糖化2~3 h后30~33 ℃发酵60~70 h,针对发酵过程染菌问题也有很多学者在研究,通常认为醋酸菌[5]和乳酸菌[6]是主要污染杂菌,它们通过生长、代谢产酸会对酿酒酵母产生竞争性抑制作用[8-9]。本文酒精发酵污染样取自玉米基质酒精发酵头罐,确定了泛菌也是发酵主要污染菌之一。不仅如此,安徽茂源(木薯基质)发酵尾罐样品和安徽皖神(木薯基质)发酵混合样品也都不同程度地检出了泛菌(未发表资料),说明随着酒精发酵工艺的不断革新,酒精发酵中染菌的原因也出现了新的可能。
2.3菌株HG-201生长曲线
由图3可以看出,菌株HG-201在0~6 h为指数生长期,6 h以后为稳定期。因此选定在3 h菌株种子活力最强时添加抑菌剂,若抑菌剂对HG-201有抑菌作用,则菌株生长曲线从3 h开始呈平缓(或下降)的趋势。
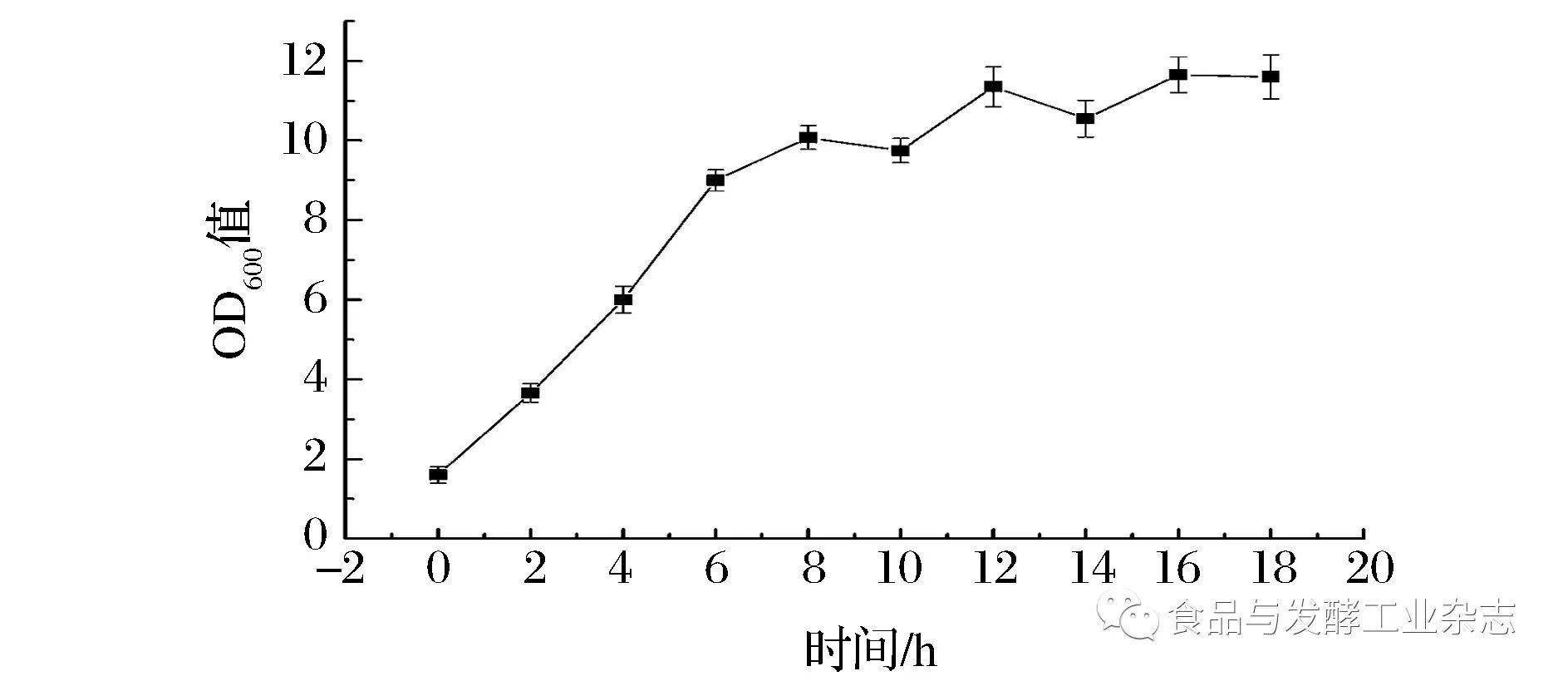
图3 菌株HG-201生长曲线
Fig.3 Growth curve of strain HG-201
2.4抑菌剂抑菌浓度的确定
如图4A所示: 相比对照组,0.25 g/L溶菌酶对菌株HG-201几乎可以起到杀菌作用,而随着溶菌酶浓度的升高,HG-201存活率逐渐降低,但菌悬液OD值水平偏高,可能是由于溶菌酶使细菌破壁后,细菌碎片影响OD值。因此,0.25~2 g/L浓度的溶菌酶都可以抑制HG-201的生长。如图4B所示: 5 U/mL葡萄糖氧化酶在3~5 h对菌株HG-201有抑菌作用,5 h以后生物量持续增加。10~30 U/mL葡萄糖氧化酶对HG-201的抑菌作用基本一致,HG-201菌悬液的OD值在3~8 h内仅从3.3增加到4.3左右。因此,10 U/mL的葡萄糖氧化酶可以作为实验浓度进行下一步的实验。
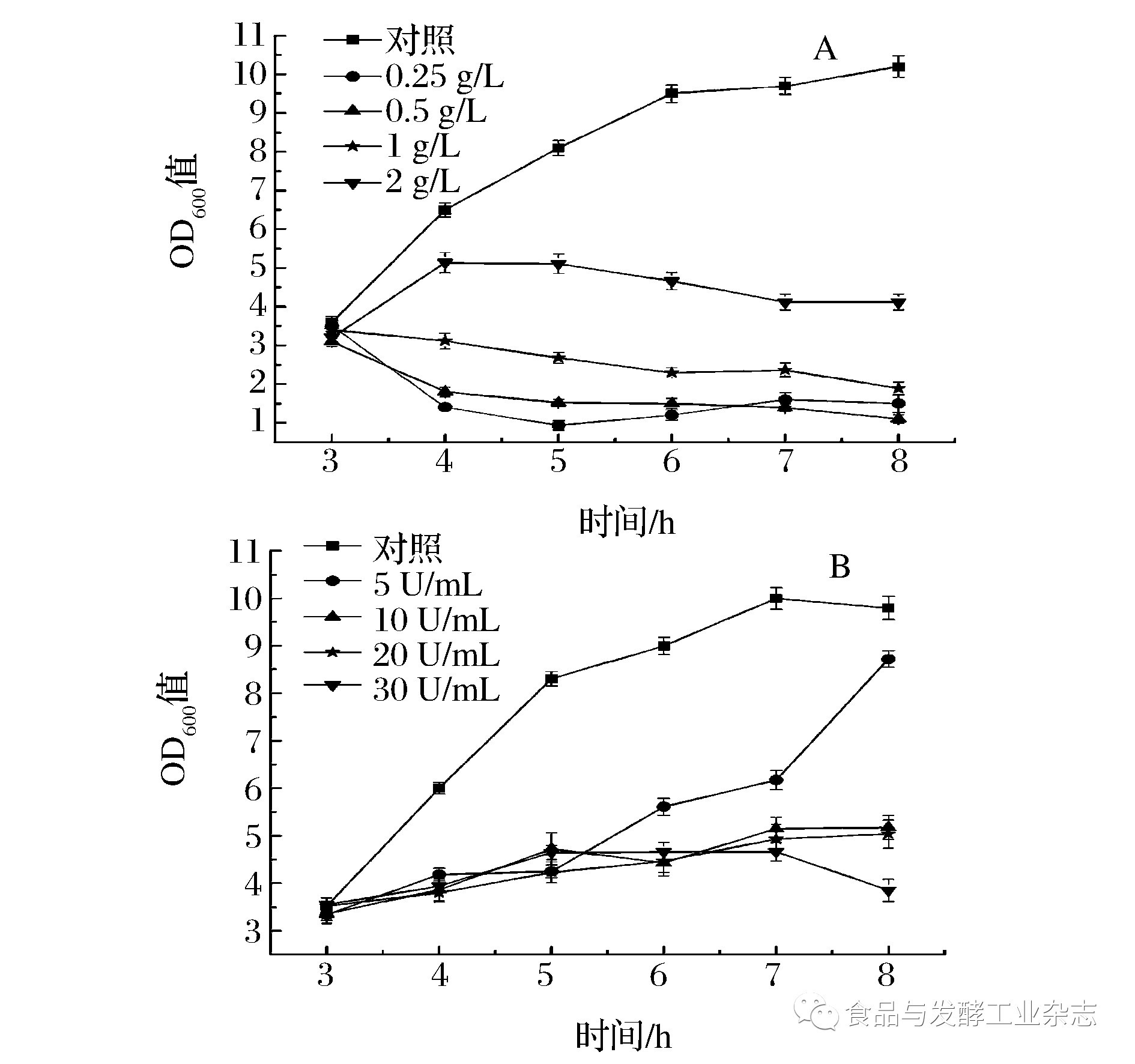
图4 不同浓度溶菌酶(A)和葡萄糖氧化酶(B)对菌株HG-201的抑菌作用
Fig.4 The antibacterial effect of different concentrations of glucose oxidase(A)and lysozyme (B) on strain HG-201
2.5不同抑菌剂对酿酒酵母生长的影响
根据图4的结果,选用10 U/mL葡萄糖氧化酶和0.25 g/L溶菌酶考察其对酵母生长的影响。如图5所示:添加抑菌剂组中酿酒酵母的生长与对照组中一致。因此,2种抑菌剂在该浓度下对酵母的生长都没有抑制作用,均可进行下一步混菌发酵实验。
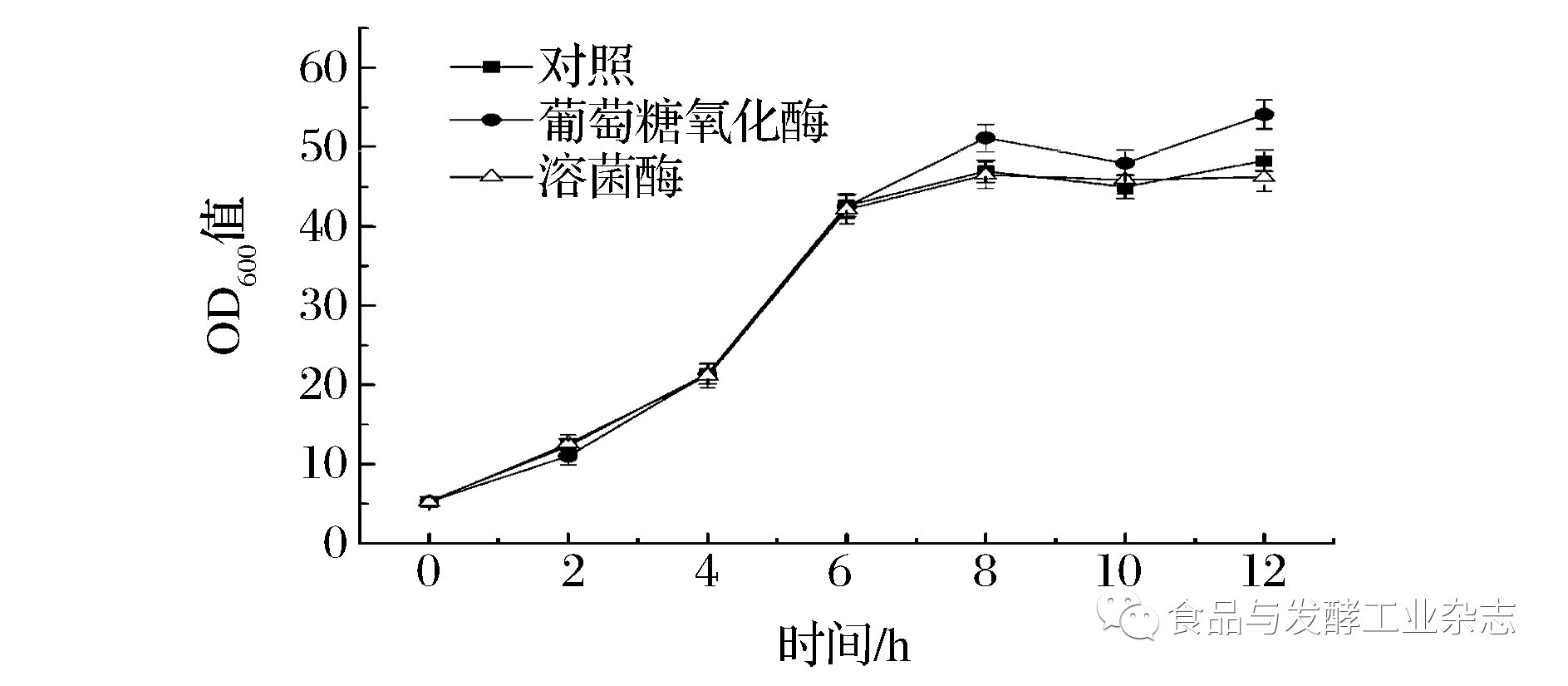
图5 10 U/mL葡萄糖氧化酶和0.25 g/L溶菌酶对酿酒酵母的作用
Fig.5 Effects of 10 U/mL glucose oxidase and 0.25 g/L lysozyme on the growth of S. cerevisiae
2.6酿酒酵母与HG-201菌株混合发酵与抑菌剂评价
2.6.1 酿酒酵母与HG-201菌株初始接种比例的确定
为了模拟工业水平酿酒酵母酒精发酵的染菌状态,使体系在发酵开始便处于严苛的染菌状态,在混合发酵前确定酿酒酵母与污染菌接种比例尤为重要。如图6所示:纯酵母发酵12 h的细胞数达到7.8×108/mL。酵母与菌株HG-201的接种比例1∶10时,HG-201对酵母的生长几乎没有影响,12 h的酵母细胞数达到7.9×108/mL。然而接种比例为1∶30时,酵母细胞数仅为2.77×108/mL,较纯酵母细胞数减少了64%。随着接种比例的提高(1∶50和1∶100时),酵母的细胞数相比1∶30的接种比例减少幅度不大。因此,选择1∶30作为酵母与HG-201混合发酵的初始接种比例。
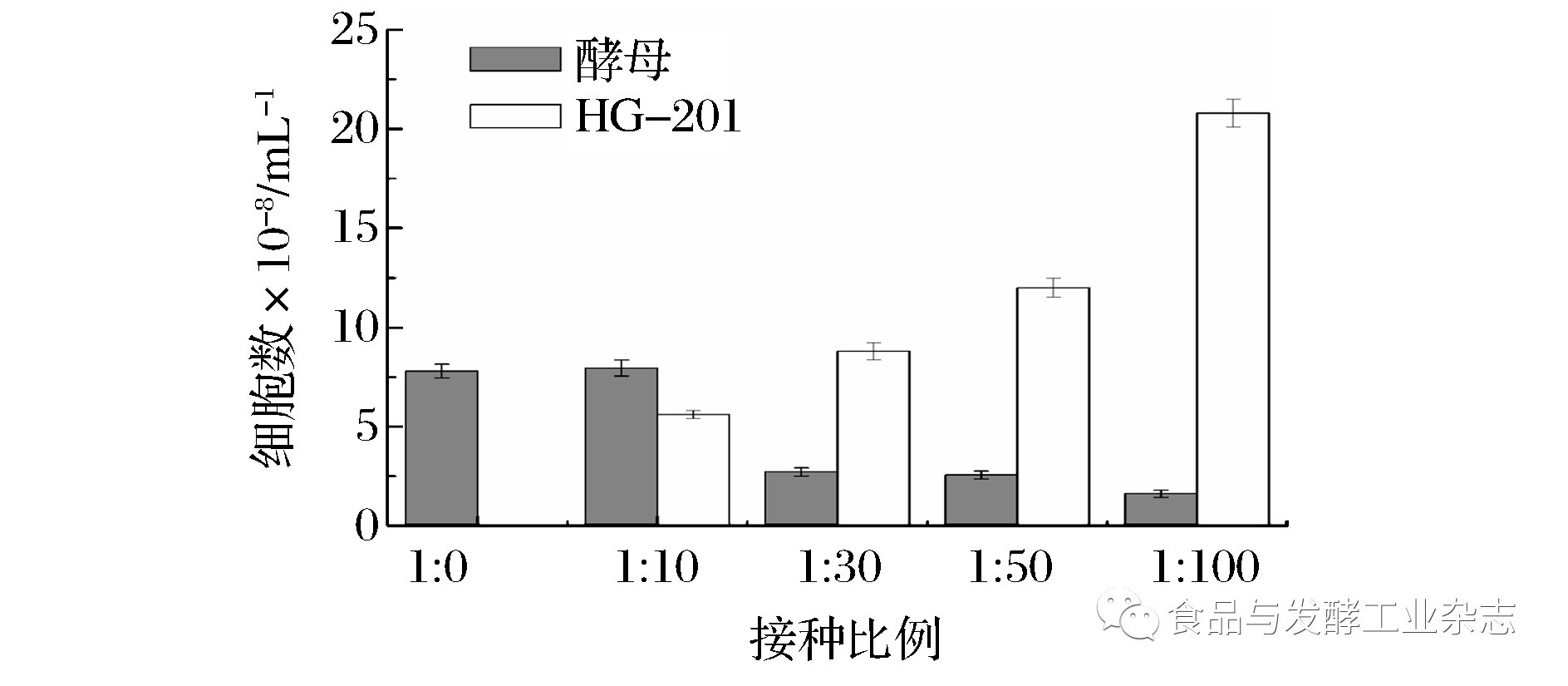
图6 不同混合比培养条件下12 h时酿酒酵母与HG-201的细胞数
Fig.6 Cell numbers of S. cerevisiae and HG-201 at 12 h in different initial mixture ratios
2.6.2 酵母与HG-201混菌发酵以及添加抑菌剂效果评价
如图7所示:酿酒酵母与HG-201进行混菌发酵,0 h酿酒酵母细胞浓度为6.4×106/mL,HG-201细胞浓度为1.92×108/mL。不添加抑菌剂时(对照)菌株HG-201在0~6 h指数生长,6 h后进入稳定期,而添加抑菌剂可以有效抑制污染菌的生长。

图7 添加抑菌剂对混菌发酵中菌株HG-201(A)和酿酒酵母(B)生长的影响
Fig.7 The effect of antibacterial agents on the growth of HG-201(A) and S.cerevisiae (B) in mixed fermentation
其中,溶菌酶抑制效果最明显,可以起到杀菌作用,HG-201的细胞数(2~10 h)维持在0.98×108/mL左右,仅为对照的5%~28%。其次是葡萄糖氧化酶,HG-201的细胞数(4~10 h)维持在4.5×108/mL左右,仅为对照的28%~40%。如图7B可知:酿酒酵母与HG-201混菌发酵,不添加抑菌剂时(对照),酵母的细胞数明显降低,比酵母纯发酵(2~10 h)的细胞数减少25%~62%。添加抑菌剂时,酵母的生长和细胞数与纯酵母几乎一致。添加葡萄糖氧化酶 4 h以后生长速率比纯酵母还高。以上结果表明:添加抑菌剂对混菌发酵中酵母的生长无抑制作用。
工业酒精发酵时,发酵是否异常一般依据发酵阶段每个时期的总酸和挥发酸来判断。因此,通过检测酿酒酵母与菌株HG-201混菌发酵过程中的挥发性有机酸生成量,来验证抑菌剂对HG-201的抑菌效果。同时检测乙醇产量来判断添加抑菌剂对酵母乙醇产量是否有影响。
由于杂菌HG-201可以发酵葡萄糖产酸[19],因此,如图8A所示:酵母和HG-201混菌发酵不添加抑菌剂时(对照组) VFA在2 h的浓度达到3.78 g/L,相比纯酵母发酵(2.97 g/L)高出27%。而添加抑菌剂组2 h的VFA浓度都接近3 g/L,与纯酵母发酵所产的VFA浓度接近。2~10 h所有实验组VFA积累量总体都呈下降趋势,说明这些挥发性小分子酸可以作为碳源在葡萄糖不足时被酿酒酵母重新利用,与文献[20]报道一致。
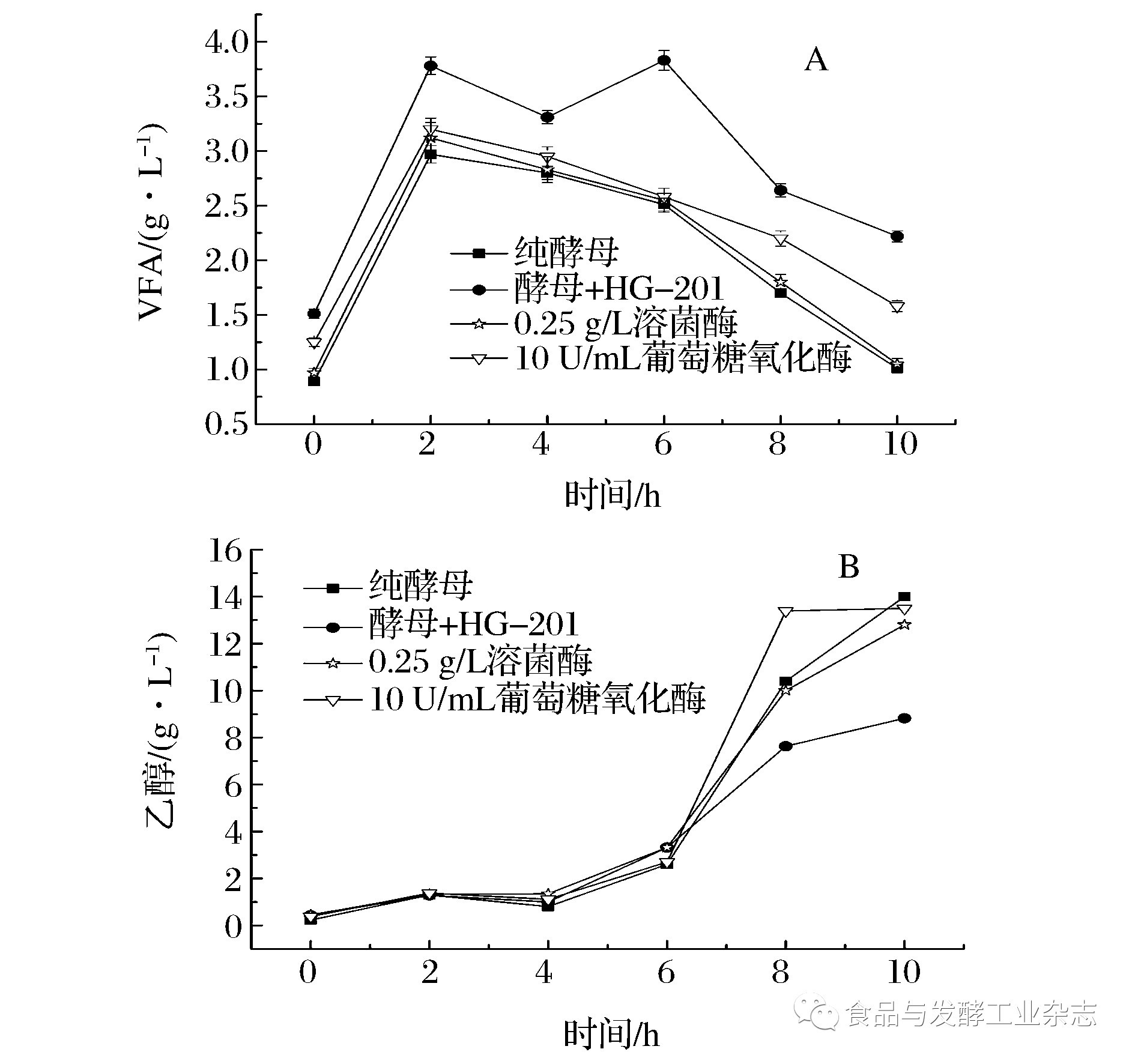
图8 抑菌剂对混菌发酵中VFA(A)和乙醇(B)浓度的影响
Fig.8 The effect of antibacterial agents on VFA and ethanol production in mixed fermentation
图8B显示了抑菌剂对混菌发酵产乙醇的影响,0~6 h乙醇缓慢积累,6 h以后随着葡萄糖的消耗,生成大量乙醇。纯酵母组和添加不同抑菌剂组在10 h乙醇量都积累到14 g/L左右。而混菌发酵不添加抑菌剂的对照组在10 h仅积累了8.82 g/L的乙醇,产量减少了37%。因此,添加抑菌剂可以抑制污染菌的生长以及产酸,并且在实验条件下对酵母的乙醇产量几乎没有影响。
3 结论
针对工业酒精发酵染菌问题,本文研究了新型抑菌剂对污染菌的抑菌作用。具体结论如下:
(1) 本实验条件下,从酒精发酵污染液中分离得到菌株HG-201,经分子生物学鉴定为泛菌。
(2)确定了10 U/mL的葡萄糖氧化酶和0.25 g/L的溶菌酶即可分别对菌株HG-201的生长产生显著的抑制作用,而对酵母纯培养的生长没有影响。
(3) 通过将酿酒酵母与HG-201混合发酵模拟酒精发酵染菌状态,不添加抑菌剂时,HG-201生长旺盛,酵母生长受到抑制,VFA生成量增加27%,乙醇产量减少37%。添加抑菌剂时,菌株HG-201的生长受到显著抑制,酵母的生长、乙醇和VFA生成趋势较纯酵母发酵几乎没有差别。
综上所述,2种新型抑菌剂对污染菌HG-201都有很好抑菌效果,为新型抑菌剂应用于工业酒精发酵过程中对杂菌的控制提供了参考。
参考文献
[1] 周裕民. 浅述酒精发酵染菌的原因及防治[J]. 食品工业, 1993(1): 29-30.
[2] 周燕. 浅谈酒精无酸发酵技术[J]. 中国科技博览, 2013(35): 213-213.
[3] OLITTA T, GOMES B F S, L0PES M L, et al. Homo- and heterofermentative lactobacilli differently affect sugarcane-based fuel ethanol fermentation[J]. Antonie van Leeuwenhoek, 2014, 105(1): 169-77.
[4] BECKNER M, IVEY ML, PHISTER TG. Microbial contamination of fuel ethanol fermentations[J]. Letters in Applied Microbiology, 2011, 53(4): 387-394.
[5] 陈苏娟. 啤酒酿造过程中醋酸菌的检测与鉴定[J]. 啤酒科技, 2006(4): 59-61.
[6] WORLEYMORSE T O, DESHUSSES M A, GUNSCH C K. Reduction of invasive bacteria in ethanol fermentations using bacteriophages[J]. Biotechnology & Bioengineering, 2015, 112(8): 1 544-1 553.
[7] ANDREW S C. New approaches to the control of contamination in biofuel ethanol fermentations[J]. Macromolecular Chemistry and Physics, 2014, 216(1): 325-336.
[8] ZHANG C M, MAO Z G, WANG X, et al. Effective ethanol production by reutilizing waste distillage anaerobic digestion effluent in an integrated fermentation process coupled with both ethanol and methane fermentations.[J]. Bioprocess and Biosystems Engineering, 2010, 33(9):1 067.
[9] 王柯, 杨圣乾, 张建华,等. 酒精-沼气双发酵耦联工艺中酒精发酵生酸原因解析与控制[J]. 食品与发酵工业, 2016, 42(12):7-12.
[10] 尚红岩. 甘蔗糖蜜酒精无酸发酵应用现状与展望[J]. 甘蔗糖业, 2014(5): 57-59.
[11] SUN Z Y, TANG Y Q, MORIMURA S, et al. Reduction in environmental impact of sulfuric acid hydrolysis of bamboo for production of fuel ethanol[J]. Bioresource Technology, 2013, 128(1): 87-93.
[12] DELLA-BIANCA B E, DE H E, PRONK J T, et al. Physiology of the fuel ethanol strainSaccharomycescerevisiaePE-2 at low pH indicates a context-dependent performance relevant for industrial applications[J]. FEMS Yeast Research, 2014, 14(8): 1 196-1 205.
[13] MADALENO L L, MINARI G D, ANNUNZIO F R D, et al. Use of antimicrobials for contamination control during ethanolic fermentation[J]. Científica, 2016, 44(2): 226.
[14] LEITE I R, FARIA J R, MARQUEZ L D S, et al. Evaluation of hop extract as a natural antibacterial agent in contaminated fuel ethanol fermentations[J]. Fuel Processing Technology, 2013, 106(2): 611-618.
[15] CAPPANNELLA E, BENUCCI I, LOMBARDELLI CLAUDIO, et al. Immobilized lysozyme for the continuous lysis of lactic bacteria in wine: Bench-scale fluidized-bed reactor study[J]. Food Chemistry, 2016, 210: 49.
[16] MUTHAIYAN A, LIMAYEM A, RICKE S C. Antimicrobial strategies for limiting bacterial contaminants in fuel bioethanol fermentations[J]. Progress in Energy and Combustion Science, 2011, 37(3): 351-370.
[17] 汤海鸥, 高秀华, 姚斌,等. 葡萄糖氧化酶体外抑菌和产酸效果试验研究[J]. 饲料工业, 2015(10): 13-16.
[18] 中国科学院成都生物研究所. 沼气发酵常规分析[M]. 北京:中国农业出版社, 2000.
[19] JUNG I, PARK D H, PARK K A. Study of the growth condition and solubilization of phosphate from hydroxyapatite byPantoeaagglomerans[J]. Biotechnology and Bioprocess Engineering, 2002, 7(4):201-205.
[20] MULOPO J, GREBEN H, SIGAMA J, et al. The relationships between sulphate reduction and COD/VFA utilization using grass cellulose as carbon and energy sources[J]. Applied Biochemistry and Biotechnology, 2011, 163(3): 393-403.
Isolationofcontaminationbacteriafromindustrialscalealcoholfermentationandapplicationofnovelantibacterialagents
LIU Ying1, CHEN Xiong1, LIAO Bei2, LI Zhi-jun2, WANG Zhi1*
1 (Key Laboratory of Fermentation Engineering (Ministry of Education), Hubei Provincial Cooperative Innovation Center of Industrial Fermentation, Hubei Key Laboratory of Industrial Microbiology, Hubei University of Technology, Wuhan 430068,China) 2 (Hubei Angel Yeast Limited by Share Ltd, Yichang 443003,China)
ABSTRACTIn order to study the application of the novel antibacterial agents for the contamination bacteria control in alcohol fermentations, the main contaminating strain HG-201 was isolated from the alcoholic fermentation liquor. 16S rDNA sequence analysis of strain HG-201 showed 99% homology toPantoeaananatis(JX215331). The effect of antibacterial agents on strain HG-201 was determined by adding novel antibacterial agents, namely, glucose oxidase and lysozyme, at mid-exponential growth phase of strain HG-201. The mixed fermentations ofSaccharomycescerevisiaeand strain HG-201 were inoculated at the ratio of 1/30, and the antibacterial agents with low concentration were added at the beginning of the fermentation. The results showed that 10 U/mL glucose oxidase and 0.25 g/L lysozyme could completely inhibit the growth and metabolism of strain HG-201 and had no effects on the growth ofSaccharomycescerevisiaeand the ethanol yield under experimental conditions. It provides a reference for the application of new antibacterial agents in the contamination bacteria control in industrial scale ethanol fermentation.
Key wordsalcohol fermentation; contamination bacteria; glucose oxidase; lysozyme
DOI:10.13995/j.cnki.11-1802/ts.014343
第一作者:硕士研究生(王志副教授为通讯作者,E-mail:476462848@qq.com)。