北京化工大学王兴教授:一氧化氮增强近红外二区光动力疗法清除深层组织中的多药耐药生物被膜
时间:2024-01-25 08:54:21 来源:BioactMater生物活性材料 点击量:
光动力疗法的主要挑战之一是难以治疗深层病理组织。为此,北京化工大学王兴教授在科爱创办的期刊Bioactive Materials上发表学术论文:一氧化氮增强近红外二区光动力疗法清除深层组织中的多药耐药生物被膜。作者设计了一种近红外二区光敏聚合物(1064 nm),即使在2.6 cm的组织屏障下也能保持50%的活性氧(ROS)产率,为治疗深层组织的生物被膜提供了新素材。
01 研究内容简介
生物被膜感染是临床上的一个棘手问题,尤其是由多药耐药(MDR)细菌引起的生物被膜。光动力疗法(PDT)具有独特的低侵袭性、高可控性和低毒性,被认为是治疗生物被膜的一种可行策略。然而,PDT在生物被膜治疗中需要面对多重挑战。一方面,生物被膜的胞外多糖(EPS)能阻止光敏剂(PS)的渗透;生物被膜内部的谷胱甘肽(GSH)通过消耗PS产生的ROS降低PDT杀菌活性。为此,应对策略通常采用联合疗法来增强PDT。特别是联合一氧化氮(NO)前体化合物,通过响应释放NO,结合PDT产生的ROS可以生成杀菌活性更高的活性氮(RNS,过氧亚硝酸根阴离子),从而增强杀菌效果。另一方面,传统PS的激发波长通常在可见光或近红外I区(NIR-I,低于900 nm),组织穿透深度有限。其中,NIR-I穿透皮肤深度约3-6毫米,主要用于治疗表皮(100 µm)和真皮(1-4 mm)感染。因此,挑战厘米级组织屏障寄希望于近红外II区(NIR-II,1000–1700 nm)光敏剂。目前,近红外II区光敏剂的研发依然存在挑战。该文章从NIR-II光敏聚合物的设计和深层治疗两方面对其在抗生物被膜的体外体内活性进行了详细研究。
一、光敏聚合物和一氧化氮载体的设计(图1)
图1:PNIR- II和PSNO的结构、NPs自组装及其响应机制。
设计制备了具有–(–D–A1–D–A2–)n– 循环结构和二硫键的光敏聚合物PNIR-II。要点包括:(1)通过增加供体-受体(D-A)结构来延长π-共轭体系,从而增加PS的吸收波长并减少S1-T1能隙(ΔES-T);(2)设计刚性π-共轭结构,可以为PDT的系间交叉(Inter System Crossing,ISC)跃迁分配更多的激发能量;(3)二硫键结构具有GSH响应性,赋予聚合物可降解功能,提高了聚合物的生物安全性。
设计制备了一种两亲性NO供体聚合物PSNO。要点包括:(1)通过环己烷四甲酸二酐和缩硫酮结构聚合,并用mPEG5000-OH获得两亲性聚合物;(2)设计NO供体S-亚硝基硫醇 (SNO) 修饰两亲性聚合物获得PSNO;(3)缩硫酮结构具有ROS响应性,使PSNO具有可降解功能。
PNIR-II与PSNO通过自组装形成多功能纳米粒子(NPs),NPs具有中性电势,有利于进入生物被膜。其响应机制如下:(1)NPs进入生物被膜后,GSH会触发 PSNO释放NO,并使PNIR-II中二硫键断裂,两者共同作用会快速消耗GSH,避免对后续PDT生成的ROS产生损耗;(2)当1064 nm激光辐射时,PNIR-II迅速产生ROS,进而与NO形成杀菌活性更强的RNS,有效清除生物被膜;(3)ROS触发PSNO中缩硫酮结构的降解,从而导致NPs全面降解。
二、体外光动力性能
选取808 nm激光与1064 nm激光进行对比研究(图2)。EPR测试发现,NPs在808 nm或1064 nm激光辐射下均产生强度为1:1:1的信号峰,表明ROS类型为单线态氧;1064 nm激光辐射下信号峰强度显著高于808 nm激光辐射,这说明NPs对1064 nm激光辐射更为敏感。
图2:NPs体外光动力性能,PNIR- II在不同厚度的组织屏障下的NIR-II光动力性能和PNIR-II的理论计算。
为了研究PNIR-II在组织屏障下的ROS生成效率,使用猪肉组织作为散射介质和组织屏障。研究结果显示,PNIR-II在10 mm厚度的组织屏障下,经808 nm激光辐射无法生成ROS;相比之下,PNIR-II在26 mm厚度的组织屏障下,经1064 nm激光辐射仍然具有50%以上的ROS产率。进而,利用密度泛函理论(DFT)对PNIR-II的–(–D–A1–D–A2–)n–循环结构进行结构优化,并通过B3LYP/6-31G*方法计算PNIR-II的电子分布。结果发现,循环结构在同一平面上,具有刚性结构,对提高三重态激发态的稳定性起到支持作用;PNIR-II的烷烃链扭转避免了循环结构的过度π-π堆积。上述结构有利于PNIR-II将能量分配在荧光和PDT。同时,电子分布显示PNIR-II存在明显的电子转移现象,可以提高PNIR-II的系间交叉效率,使PNIR-II具有较好的光动力效果。上述两个因素有助于PNIR-II提高活性氧产率,减少光热效应。测试结果表明,PNIR-II在1064 nm激光辐射下没有表现出明显的光热效应(图S16)。可见,PNIR-II是一种可以提供深度治疗的红外二区光敏剂。
图S16:Temperature variation curves of PNIR-II (1 mg/mL) solutions and water after irradiation by a 1.0 W/cm2 1064 nm laser for 5 min.
三、体内光动力性能
通过小鼠生物被膜感染模型进一步研究了NPs在体内的光动力性能(图3)。NPs通过微静脉注射到小鼠体内,利用NIR-II荧光成像系统探究了NPs在体内的分布情况。结果表明,感染区域的NIR-II荧光强度随着时间的推移而增加,这意味着在体内NPs通过被动靶向蓄积在生物被膜感染位置。此外,将主要脏器和感染位置进行离体荧光成像,结果显示NPs可以有效蓄积在生物被膜感染位置。
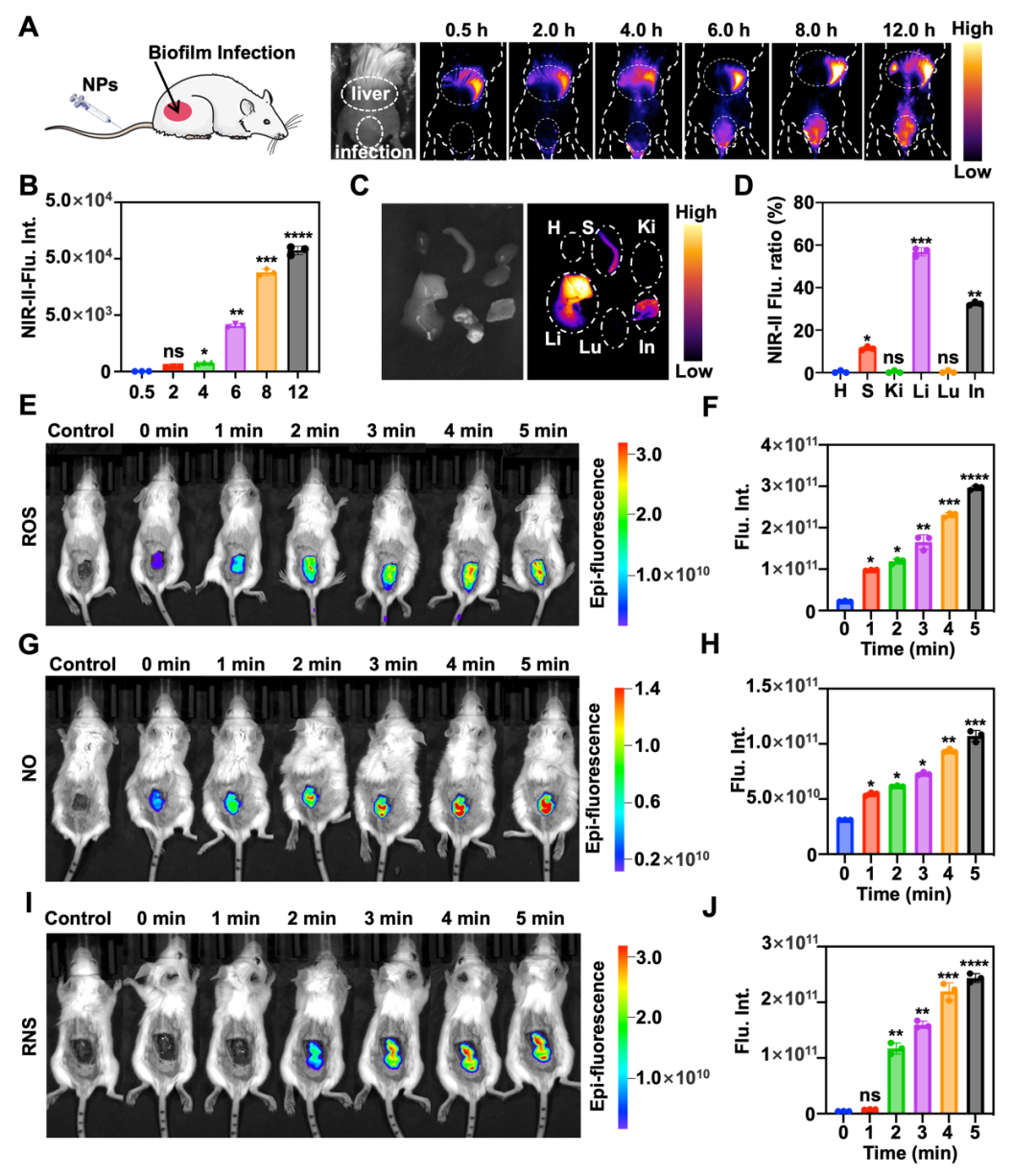 图3:NPs的体内分布,以及NPs在体内ROS,NO和RNS的生成。
图3:NPs的体内分布,以及NPs在体内ROS,NO和RNS的生成。使用生物成像进一步评估了NPs体内光动力性能。主要包括NPs释放ROS、NO和RNS的能力:(1)ROS成像表明,随着1064 nm激光照射时间的增加,ROS的产生量逐渐增加。这证明NPs可以在体内产生ROS;(2)NO成像显示,随时间增加、荧光强度持续增加,表明体内生物膜中表达的GSH触发了NO释放;(3)RNS成像显示,1064 nm激光辐射不会在短时间内产生RNS(< 1 min)。随着1064 nm激光辐射时间的增加,感染位置开始出现荧光,并且荧光强度迅速增加。这意味着RNS的生成需要一定的激光辐射时间(> 2 min)。生物成像验证了NPs在体内生物被膜感染位置能够稳定产生ROS,释放NO并生成RNS。这为深度治疗体内生物被膜感染提供了有效保障。
四、体内生物被膜清除效果
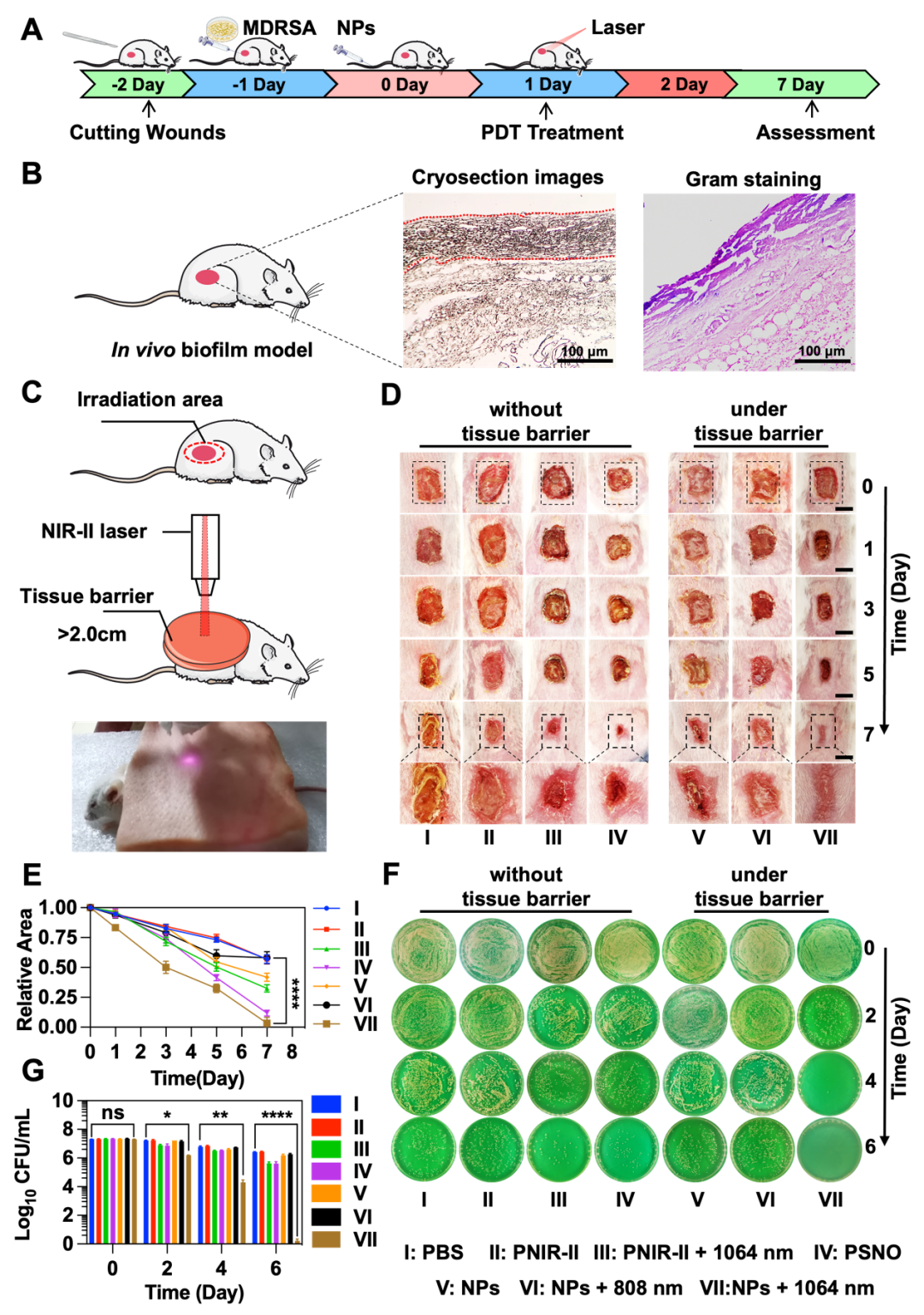
建立小鼠伤口感染模型(图4):(1)在–2天构建伤口;(2)在–1天移植MDRSA;(3)第0天,MDRSA会在伤口处形成生物被膜,并通过微静脉注射NPs;(4)第1天进行10 min激光辐射治疗;(5)2-7天记录治疗情况。该模型具有生物被膜感染模型特征:(1)冰冻切片中正常组织出现大约~90 μm的致密结构;(2)革兰氏染色实验将该致密结构浸染为紫色,这是革兰氏阳性菌的特征。上述特征证实了致密结构属于生物被膜。
图4:体内生物被膜的建立和不同治疗组抗生物被膜效果。
为了模拟治疗深层生物被膜,在治疗过程中引入了2.2厘米厚的猪肉组织屏障。治疗结果显示:第0天,在所有组中观察到严重感染;第1天,在组织屏障下提供激光照射处理(808 nm、1064 nm)10分钟,NPs+1064 nm激光组即使在屏障组织下也能有效消除MDRSA生物被膜;第3天,NPs+1064 nm激光组的生物被膜显著消失,而其他治疗组仍显示出生物被膜;第5天,NPs+1064 nm激光组显著愈合;第7天, NPs+1064 nm激光组的伤口已经成功愈合,有疤痕,而其他治疗组的伤口仍存在。相对伤口面积统计显示,尽管PSNO治疗组在相同剂量下能够促进愈合,但生物被膜清除效率明显低于NPs+1064 nm激光组。值得注意的是,NPs+808 nm激光组在组织屏障下没有表现出任何治疗效果。治疗组小鼠体重变化显示NPs+1064 nm激光组治疗的小鼠体重逐渐增加,证实了NPs+1064 nm激光组治疗的有效性。
通过平板计数方法检测小鼠体内生物被膜模型中的细菌数量。结果显示,在治疗后第2天,NPs+1064 nm激光组的细菌数量显著减少。在第4天,细菌数量减少到104 CFU/mL。第6天,细菌基本消失。这意味即使在存在屏障组织的情况下,NPs+1064 nm激光组也能够有效清除生物被膜并杀死膜内细菌。相比之下,虽然PNIR-II+L和PSNO组能够抑制生物被膜,但细菌数量依旧很高。这些结果进一步验证了NPs+1064 nm激光治疗可以有效清除厘米级别的深层生物被膜。
最后作者指出NPs在进入MDRSA生物膜后,NPs被触发降解并有序破坏生物被膜微环境,特别是通过准确释放NO,然后在1064 nm激光照射下产生抗菌活性更强的RNS来破坏生物被膜。该报道的聚合物PNIR-II是可以应用在厘米级组织屏障下最有效的NIR-II 光敏剂之一,为深层次生物被膜的治疗带来突破性的进展。
02 第一/通讯作者简介
第一作者:
卜凡强:北京化工大学生命科学与技术学院2020级博士研究生,主要从事光热/光动力清除生物被膜方向的研究工作。
通讯作者:
王兴:有机-无机复合材料国家重点实验室,北京生物医学材料实验室,北京化工大学生命与科学技术学院,教授,博士生导师,科研/外事副院长。
主要从事生物医用材料在抗菌、止血和药物递送领域的基础研究与应用。主持国家自然科学基金、北京重点专项(首席科学家)、领域基金、基础研究、外专项目和企业技术开发项目等23项。发表SCI论文80余篇,h指数32。授权发明专利20件,转让2件。
课题组主页: http://www.wangxing-lab.com
03 资助信息
该研究获国家自然科学基金(52273118;22275013)、北京市自然科学基金重点项目(Z200025)、国家创新药物重大专项(2019ZX09721001-007-002)和中央高校基本科研业务费(BHYC1705B)的资助。感谢中科院化学所肖海华研究员,中日友好医院刘芳副主任和齐齐哈尔大学陈林副教授的支持与帮助。
04 原文信息
Fanqiang Bu, XiaoxuKang, Dongsheng Tang, Fang Liu, Lin Chen, Pengfei Zhang, Wenli Feng, YingjieYu, Guofeng Li, Haihua Xiao, Xing Wang*.
Enhancing near-infrared II photodynamic therapy with nitric oxide for eradicating multidrug-resistant biofilms in deep tissues.
Bioactive Materials, 33 (2024), Pages 341-354.
https://doi.org/10.1016/j.bioactmat.2023.11.006
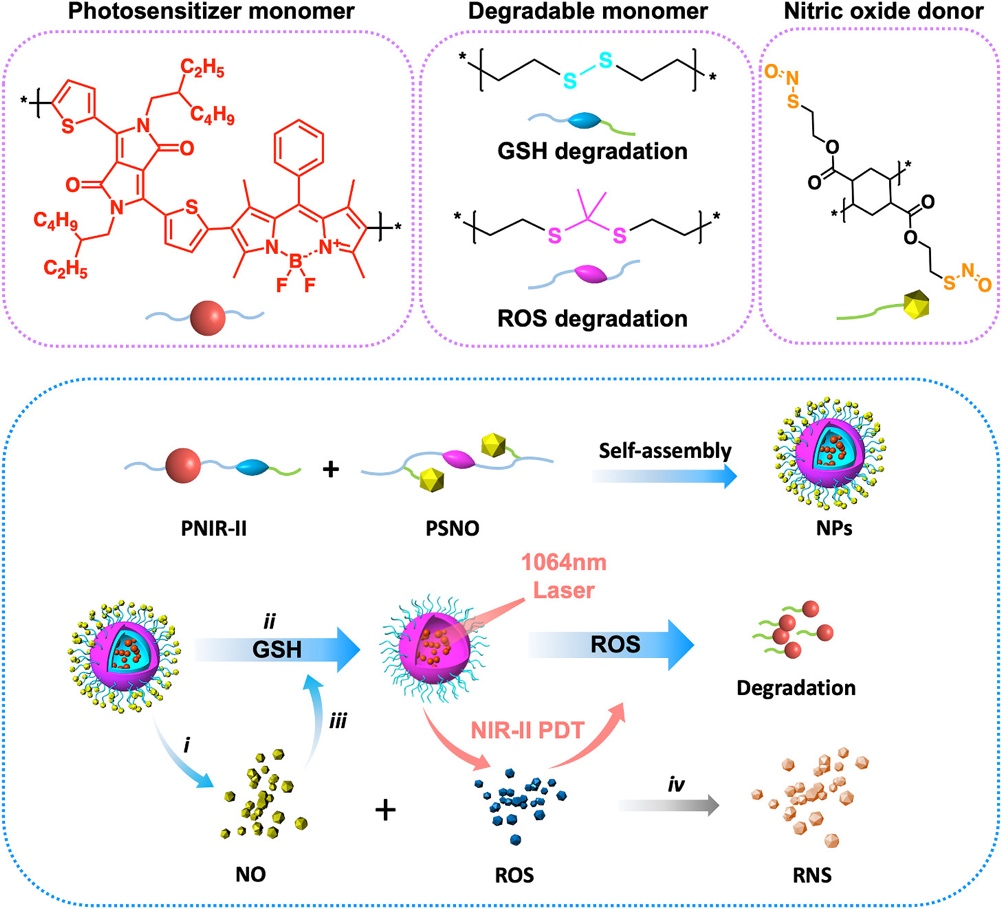
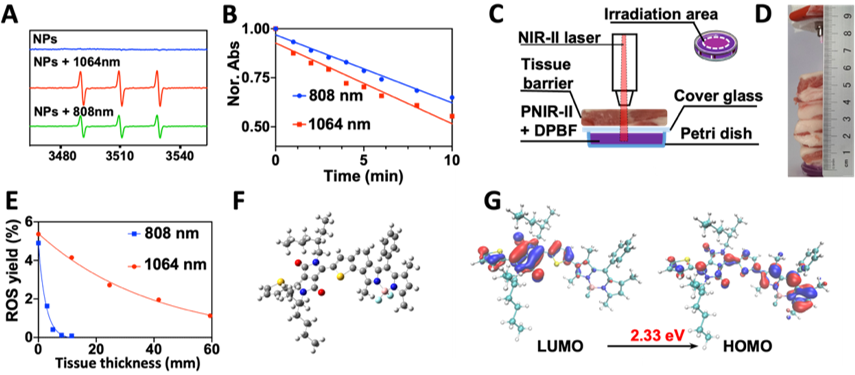
 图3:NPs的体内分布,以及NPs在体内ROS,NO和RNS的生成。
图3:NPs的体内分布,以及NPs在体内ROS,NO和RNS的生成。